RESUMO
O aspecto mais enigmático da ascensão da Candida auris como patógeno humano é que ela emergiu simultaneamente em três continentes, sendo cada um deles geneticamente distinto. Embora novas espécies fúngicas patogênicas sejam descritas regularmente, estas são, na maioria das vezes, associadas a casos isolados em indivíduos imunossuprimidos. Neste estudo, usamos análise filogenética para comparar a suscetibilidade à temperatura da C. auris com os de seus parentes próximos e usar esses resultados para argumentar que pode ser o primeiro exemplo de uma nova doença fúngica emergindo da mudança climática, com a ressalva que muitos outros fatores podem ter contribuído.
A infecção pelo Candida auris é resistente a medicamentos e pode ser fatal – Fonte – Reuters
OPINIÃO / HIPÓTESE
Candida auris é uma nova espécie de fungo resistente a medicamentos que foi isolada pela primeira vez em 2009 a partir de um canal auditivo humano e, portanto, denominada “auris” (1). Desde então, a C. auris tem sido associado com doença humana em muitos países, e os isolados clínicos são notáveis por exibirem a não suscetibilidade aos agentes antifúngicos. Um dos desenvolvimentos notáveis associados ao aparecimento da doença relacionada à C. auris é que os isolados patogênicos parecem ter emergido de forma independente em três continentes simultaneamente (2). A análise dos isolados recuperados do subcontinente indiano, Venezuela e África do Sul durante 2012 a 2015 revelou que os isolados de cada continente eram clonais, mas que os de diferentes continentes constituíam clados geneticamente diferentes (2). O (s) mecanismo (s) responsável (is) pelo surgimento simultâneo de três diferentes clados (agrupamento que inclui um ancestral comum e todos os descendentes viventes e extintos desse ancestral) da C. auris em três regiões geograficamente distantes são inexplicáveis.
O uso difundido de drogas antifúngicas tem sido sugerido como causa contributiva no surgimento de C. auris (3). Embora a seleção pelo uso de azóis ambientais possa certamente ter contribuído para a resistência a drogas nessa espécie de fungo, não é fácil explicar por que esse organismo repentinamente se tornou um patógeno humano em três continentes. Por exemplo, o surgimento da Candida spp. resistente a azólicos começou muito antes do aparecimento da C. auris, e parece não haver uma correlação entre o surgimento de Aspergillus spp. resistente a azolicos associados ao uso agrícola e os hot spots para a surgimento da C. auris.
É muito improvável que a aquisição de resistência a drogas confira ao micróbio a capacidade de patogenicidade, pois a suscetibilidade reduzida a fármacos e a virulência são propriedades muito diferentes, como evidenciado pelos frequentes esforços de adaptação associados a mutações que conferem resistência dos antifúngicos a Candida (4, 5). Em vez disso, como exemplificado pela experiência com Aspergillus fumigatus, a aspergilose (doença infecciosa causada pelo fungo Aspergillus sp.) era bem conhecida antes de sua suposta resistência a drogas a partir do uso agrícola de azóis (6). Portanto, pode-se esperar que a C. auris tenha sido conhecida como um patógeno humano e animal primeiramente e depois tenha adquirido resistência a medicamentos, em vez de emergir como resistente a defensivos agrícolas ao mesmo tempo em que se tornou um patógeno humano. Outra explicação sugerida para o surgimento da C. auris é que recentemente adquiriu características de virulência que conferem a capacidade de virulência (7). Embora essa explicação não possa ser descartada, a capacidade de virulência é uma propriedade complexa que emerge de muitos atributos, e é improvável que ela tenha ocorrido simultaneamente em três continentes, a menos que motivada por outro fator selecionado para ela.
Os fungos patogênicos em humanos constituem apenas uma minoria de um número enorme de espécies de fungos no ambiente, numerando-se em poucas centenas (8). Em contraste com plantas e animais ectotérmicos (animais cuja temperatura do corpo varia, de acordo com a temperatura do ambiente onde se encontram), os mamíferos são notavelmente resistentes a doenças fúngicas invasivas. A resistência dos mamíferos às doenças fúngicas invasivas é proposta como resultado de uma combinação de altas temperaturas basais, que criam uma zona de restrição térmica, e mecanismos avançados de defesa do hospedeiro na forma de imunidade adaptativa e inata (9). Neste sentido, o surgimento de animais termodinamicamente desfavoráveis como mamíferos, os grandes animais dominantes foram propostos como resultado de um filtro fúngico no limite Cretáceo-Terciário que impediu uma segunda idade reptiliana (9). De acordo com essa teoria, patógenos fúngicos são raros em mamíferos porque esse grupo de animais foi selecionado pelos fungos no final do período Cretáceo (9). De acordo com essa visão, os fatos mostram que a maioria dos fungos crescem bem em temperaturas ambientes e que apenas uma pequena porcentagem de espécies pode se reproduzir a 37°C (10). Consequentemente, as infecções fúngicas invasivas são raras, a menos que um desses dois pilares de resistência seja perturbado. Por exemplo, a alta prevalência de micoses em indivíduos com infecção avançada pelo HIV foi resultado de um enfraquecimento do sistema imunológico, enquanto a “síndrome do nariz branco” em morcegos ocorre durante o processo de hibernação, quando a temperatura cai (11).
A zona de restrição térmica que protege os mamíferos é a diferença entre suas altas temperaturas basais (do organismo) e as temperaturas ambientais. A mudança climática induzida pelo homem está prevista para aquecer a Terra em vários graus no século XXI, o que reduzirá a magnitude do gradiente entre a temperatura ambiente e as temperaturas basais dos mamíferos (12). Consequentemente, existe a preocupação de que temperaturas ambientes mais elevadas levarão à seleção de linhagens fúngicas, para se tornarem mais tolerantes termicamente, de tal forma que possam romper a zona de restrição térmica de mamíferos. Neste sentido, experimentos com um fungo entomopatogênico (fungo que pode parasitar insetos, matando-os ou incapacitando-os) mostraram que estes podem ser rapidamente adaptados ao crescimento em altas temperaturas por seleção térmica (13), estabelecendo um precedente para um fungo patogênico animal que se adapta às temperaturas basais dos mamíferos. Mais preocupante, a análise de tolerâncias térmicas para isolados de fungos depositados em uma coleção de culturas mostrou uma tendência de basidiomicetos (ordem de fungos a que pertence o cogumelo) para uma capacidade aumentada de se replicar em altas temperaturas, uma observação consistente com uma adaptação precoce para temperaturas de ambientes mais elevadas a partir do final do século XX (14). Apoiando a noção de adaptação em resposta à temperatura, as espécies de fungos nas cidades tornaram-se mais termotolerantes do que nas suas zonas rurais (15). Uma análise da correlação de tolerância de temperatura com latitude (para cepas isoladas nas últimas décadas e descrita na referência 14) mostrou que as correlações de Pearson entre o crescimento máximo de temperatura de todos os fungos, ascomicetes (por exemplo, Candida spp., Aspergillus spp., Histoplasma spp., etc.) e basidiomicetos (por exemplo, Cryptococcus spp., etc.) foram -0,14619, -0,054638414 e -0,304251976, respectivamente. A falta de uma tendência significativa para os ascomicetes é consistente com o fato de que esse grupo pode crescer em temperaturas ambientes mais elevados e, portanto, crescer em todas as latitudes. Para os basidiomicetos, a tendência significativa limítrofe sugere que estes estão se adaptando às condições mais quentes em latitudes mais altas, possivelmente por causa do aquecimento climático, consistente com nossa análise anterior (14). Dada a capacidade das espécies de fungos para se adaptarem a temperaturas mais elevadas e o fato de que muitas espécies de fungos que atualmente não são patogênicas provavelmente possuem os atributos de virulência necessários em virtude de sua sobrevivência nos solos, supomos anteriormente que as mudanças climáticas trariam novas doenças fúngicas. (12).
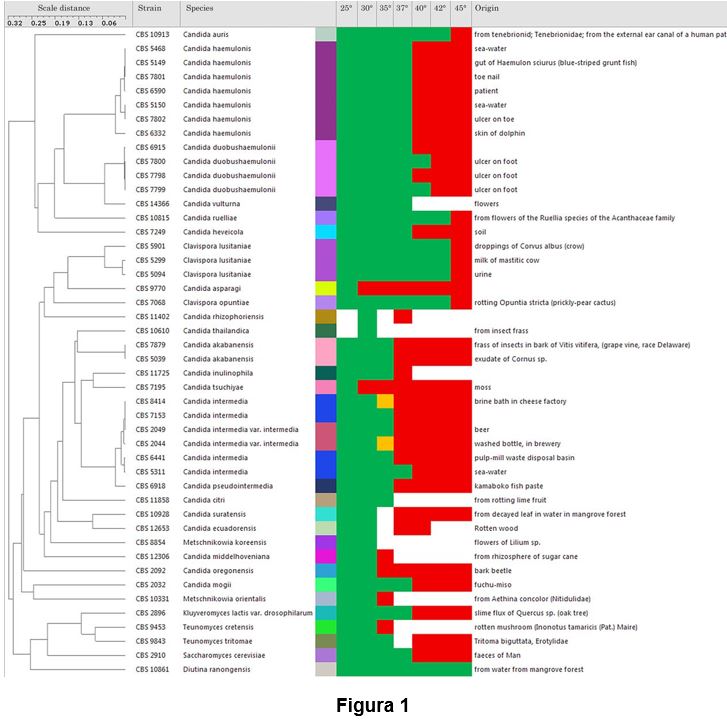
A C. auris é uma levedura que pertence à classe dos ascomicetos e um parente próximo do complexo de espécies da Candida haemulonii, que inclui espécies ocasionalmente patogênicas em humanos e animais e demonstra um alto nível de resistência a drogas antifúngicas na linha de base (16). Essa conexão filogenética pode explicar sua baixa suscetibilidade a agentes antifúngicos e a posse de atributos de virulência que lhe conferem potencial patogênico. Para avaliar nossa hipótese, comparamos a suscetibilidade térmica da C. auris com alguns de seus parentes filogenéticos próximos e descobrimos que a maioria desses parentes não eram tolerantes a temperaturas de mamíferos (Fig. 1). Embora esta árvore revele que a C. auris é capaz de crescer a temperaturas mais altas que a maioria de suas espécies próximas, ela não informa se esta é uma nova característica. Vale ressaltar que a descrição mais antiga da C. auris veio de uma cepa recuperada de um ouvido humano, que é muito mais fria que as temperaturas corporais centrais. Assim, este fungo pode ter passado por um curto período transitório durante o qual habitou as superfícies humanas antes de estar associado à doença. Atualmente, a C. auris coloniza preferencialmente a pele mais fria em vez do microbioma intestinal mais quente, uma preferência que pode ser consistente com uma recente aquisição da termotolerância.
Comparação da tolerância térmica da C. auris e vários parentes próximos. A árvore mostra que a tolerância térmica não é monofilético para espécies intimamente relacionadas. Verde e vermelho refletem a permissividade e a não-permissividade da temperatura, respectivamente, para o crescimento. Candida spp. com um limite superior de crescimento a 37°C, não se espera que cresçam a temperaturas de febre. Espécies intimamente relacionadas manifestam tolerâncias térmicas mais baixas que a C. auris. A árvore hierárquica (unweighted pair group method using average linkages [UPGMA]) baseia-se nas sequências de pares alinhados de ambos os espaçadores transcritos internos e grande subunidade de ADN ribossômico (dados obtidos e disponíveis na coleção CBS em www.westerdijkinstitute.nl).
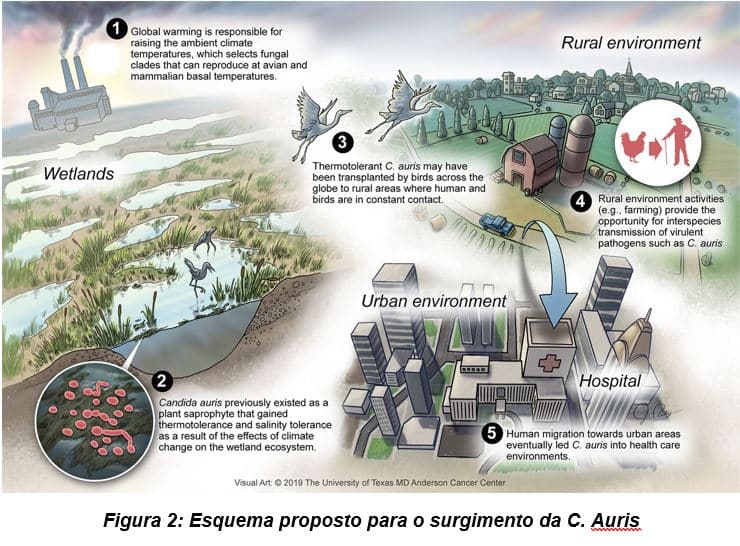
Neste contexto, supomos que a Candida auris é o primeiro exemplo de um novo fungo patogênico emergente do aquecimento global induzido pelo homem. E que antes de seu reconhecimento como patógeno humano, a C. auris era um fungo de ambiente. O fato da C. auris não crescer anaerobicamente, juntamente com o fato de ser tipicamente detectado em locais mais frios da pele, mas não no intestino, sustenta a noção de que a C. auris era um fungo de ambiente, até recentemente. Vários fatores, não necessariamente mutuamente exclusivos, podem ter funcionado a respeito de porquê a C. auris emergiu na última década. Por exemplo, com a sobrecarga na C. auris por HSP 90, isso pode explicar sua resistência a múltiplos fármacos, virulência, tolerância térmica e tolerância a estresse osmótico (17). Assim, a C. auris pode ter existido anteriormente como uma planta saprófita em ecossistemas especializados, tais como zonas úmidas. Como primeiro passo, seu surgimento pode estar associado ao aquecimento global (incluindo oscilações climáticas) efeitos em áreas úmidas (18), e seu enriquecimento nesse nicho ecológico foi o resultado da tolerância térmica combinada e tolerância à salinidade da C. auris. Curiosamente, as áreas onde a C. auris foi reconhecida pela primeira vez se sobrepõem, pelo menos em parte, aos ecossistemas de áreas úmidas impactadas (18). O C. albicans pode ser parte de um ecossistema de zonas úmidas (19), e embora muitos dos determinantes de virulência no genoma da C. auris não tenham sido caracterizados, é teoricamente possível que a Candida spp. patogênicas em humanos passaram algumas características de virulência para cepas da C. Auris previamente não-patogênicas através da transferência de DNA plasmidial (20, 21), no cenário de mudança de nichos ecológicos. Alternativamente, o efeito da radiação UV mais alta em combinação com o aquecimento global (22) pôde ter contribuído para eventos mutagênicos que resultaram no aumento súbito da aptidão de um sapróbio para a sobrevivência em um hospedeiro, via processos dependentes de melanina ou não-melanina (23). O salto da C. auris de um fungo ambiental para um fungo capaz de ser transmitido e patogênico para humanos, poderia ter tido um hospedeiro intermediário, especificamente um hospedeiro aviário, pois fungos que crescem a 40 ou 42° C podem infectar a fauna aviária. Vale ressaltar que as aves marinhas podem servir como reservatórios para transmissão indireta de espécies da Candida resistentes a drogas, como C. glabrata, para humanos (24).A habilidade incomum da C auris em se adaptar a nichos específicos, primeiro no ambiente e depois em um hospedeiro aviário, poderia ter levado como um terceiro passo para seu estabelecimento final como um patógeno humano através de interruptores genéticos e epigenéticos (termo referido como uma extra informação genética que com ajuda de modificações de cromatina e DNA ajudam ou inibem determinado genes) (25).
A hipótese de que a C. auris rompeu a barreira térmica dos mamíferos por meio da adaptação à mudança climática sugere várias linhas experimentais de investigação para obter evidências a favor e contra. Se a tolerância térmica a C. auris é de fato uma nova propriedade, uma análise cuidadosa da faixa de temperatura que permite a replicação pode revelar que ela é ainda menos tolerante do que a Candida spp. que têm uma longa associação com os mamíferos. A esse respeito, isolados de surtos anteriores podem apresentar diferenças na tolerância térmica em relação aos surtos mais recentes. É claro que a análise da suscetibilidade térmica requer uma abordagem experimental mais detalhada para identificar pequenas diferenças que normalmente são medidas pela caracterização microbiológica de rotina. Uma busca por reservatórios ambientais pode produzir cepas de C. auris estreitamente relacionadas que ainda não se adaptaram a temperaturas mais altas, o que pode ser esperado se o processo for estocástico e apenas alguns clados realizaram a transição. O aumento da amostragem nesses ambientes e hospedeiros poderia testar o envolvimento de zonas úmidas e aves, respectivamente. Caso seja encontrada evidência para a C. auris ou parentes próximos nesses ambientes, então pode-se considerar que o hospedeiro passe de aves para humanos segue mecanismos semelhantes aos que operam para o vírus influenza. A possibilidade de que a C. auris tenha sido sempre um patógeno da área da saúde que foi descoberto recentemente, parece ter pouco apoio, já que nenhum isolado foi encontrado antes de 1996 em coleções fúngicas (3).
Caso seja encontrada evidência para a C. auris ou parentes próximos nesses ambientes, então pode-se considerar que o hospedeiro salta das aves para humanos segue mecanismos semelhantes aos que operam para o vírus influenza. A possibilidade de que C. auris tenha sido sempre um patógeno da área da saúde que foi descoberto recentemente parece ter pouco apoio, já que nenhum isolado foi encontrado antes de 1996 em coleções fúngicas (3). A avaliação dos papéis contributivos de altas densidades populacionais humanas, migrações, aumento da temperatura da cidade (15), falta de higiene, poluição e viagens regionais e internacionais (26) no surgimento da C. auris é difícil, dadas as informações disponíveis, mas essas potenciais associações são áreas férteis para pesquisa.
O surgimento da C. auris também coloca questões científicas básicas interessantes sobre a estabilidade térmica de seus processos enzimáticos e, em um sentido mais amplo, os mecanismos de virulência e adaptação para fungos patogênicos em humanos. Por exemplo, os evolutivamente conservados Hog1 stress-activated protein kinase (SAPK), o papel para o qual a virulência de C. neoformans é estabelecida (27), promove resistência ao estresse e virulência em C. auris (28), sugerindo conexões tentadoras entre mecanismos de adaptação e virulência que são propícios para estudos posteriores. Um esquema para os possíveis fatores que operam no surgimento da C. auris é mostrado na Fig. 2.
Embora as mudanças relacionadas ao aquecimento global no ambiente possam ter desempenhado um papel proeminente na emergência da C. auris, é improvável que essa variável explique toda a história. Por exemplo, é difícil ver como o aquecimento global explica a emergência espontânea de quatro clados de cepas da C. auris em regiões geograficamente distintas, cada uma separada por milhares de anos de distância evolutiva uma da outra, a menos que exista outra variável epidemiológica comum que facilitou a interação com os seres humanos para que a virulência se tornasse aparente. Supondo que a C. auris tenha outros hospedeiros na biosfera, é possível que as mudanças climáticas também afetem esses hospedeiros e forneça uma variável adicional para o surgimento deste organismo como um fungo patogênico em humanos. Observamos que o agrupamento recente de casos em certas regiões geográficas, como o nordeste dos Estados Unidos, é um evento decorrente que segue a proposta de adaptação às mudanças climáticas e provavelmente reflete questões locais de controle de infecção (29). Por fim, notamos que todos os quatro clados contêm MTLa e MTLa loci (30), o que aumenta a possibilidade de que eles possam interagir através do acasalamento se o seu atual isolamento geográfico for encerrado por descuido humano no transporte ou por aves migratórias.
Se a C. Auris é o primeiro exemplo de novos fungos patogênicos emergentes da mudança climática ou se sua origem no reino dos fungos patogênicos em humanos seguiu uma trajetória diferente, sua emanação provoca preocupações de que a humanidade possa enfrentar novas doenças, desde a adaptação de fungos a climas mais quentes. Até o momento, a maioria dos casos humanos de doença relacionada a C. auris ocorreu em indivíduos debilitados, como aqueles em unidades de terapia intensiva. Como suas condições debilitadas prejudicam sua imunidade, esse grupo pode servir como sentinelas para o surgimento de novas doenças fúngicas. Talvez a maior lição do surgimento da C. auris seja a necessidade de maior vigilância e monitoramento contínuo. A este respeito, o ambiente é susceptível de conter um grande número de espécies de fungos com potencial patogênico que são atualmente não-patogênicos para os seres humanos, porque não possuem a capacidade de crescer na temperatura dos mamíferos.
De fato, os efeitos diretos e indiretos das mudanças climáticas induzidas por uma população humana em crescimento exponencial como impulsionadores da evolução dos fungos devem ser uma área de intensa pesquisa nas próximas décadas. A ampliação da distribuição geográfica de fungos patogênicos termotolerantes inatos e a aquisição das características de virulência em fungos ambientais não patogênicos termotolerantes, podem moldar o século XXI como uma era de expansão de doenças fúngicas para a fauna e a flora do planeta.
REFERÊNCIAS
1.Satoh K, Makimura K, Hasumi Y, Nishiyama Y, Uchida K, Yamaguchi H. 2009. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a Japanese hospital. Microbiol Immunol 53:41–44. doi:10.1111/j.1348-0421.2008.00083.x.
2.Lockhart SR, Etienne KA, Vallabhaneni S, Farooqi J, Chowdhary A, Govender NP, Colombo AL, Calvo B, Cuomo CA, Desjardins CA, Berkow EL, Castanheira M, Magobo RE, Jabeen K, Asghar RJ, Meis JF, Jackson B, Chiller T, Litvintseva AP. 2017. Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin Infect Dis 64:134–140. doi:10.1093/cid/ciw691.
3.Chowdhary A, Sharma C, Meis JF. 2017. Candida auris: a rapidly emerging cause of hospital-acquired multidrug-resistant fungal infections globally. PLoS Pathog 13: e1006290. doi: 10.1371/journal.ppat.1006290.
4.Vincent BM, Lancaster AK, Scherz-Shouval R, Whitesell L, Lindquist S. 2013. Fitness trade-offs restrict the evolution of resistance to amphotericin B. PLoS Biol 11: e1001692. doi: 10.1371/journal.pbio.1001692.
5.Ben-Ami R, Kontoyiannis DP. 2012. Resistance to echinocandins comes at a cost: the impact of FKS1 hotspot mutations on Candida albicans fitness and virulence. Virulence 3:95–97. doi:10.4161/viru.3.1.18886.
6.Abdolrasouli A, Rhodes J, Beale MA, Hagen F, Rogers TR, Chowdhary A, Meis JF, Armstrong-James D, Fisher MC. 2015. Genomic context of azole resistance mutations in Aspergillus fumigatus determined using whole-genome sequencing. mBio 6:e00536-15. doi:10.1128/mBio.00536-15.
7.Lamoth F, Kontoyiannis DP. 2018. The Candida auris alert: facts and perspectives. J Infect Dis 217:516–520. doi:10.1093/infdis/jix597.
8.Kwon-Chung KJ, Bennett JE. 1992. Medical mycology. Lea & Febiger, Philadelphia, PA.
9.Casadevall A. 2012. Fungi and the rise of mammals. PLoS Pathog 8:e1002808. doi:10.1371/journal.ppat.1002808.
10.Robert VA, Casadevall A. 2009. Vertebrate endothermy restricts most fungi as potential pathogens. J Infect Dis 200:1623–1626. doi:10.1086/644642.
11.Blehert DS, Hicks AC, Behr M, Meteyer CU, Berlowski-Zier BM, Buckles EL, Coleman JT, Darling SR, Gargas A, Niver R, Okoniewski JC, Rudd RJ, Stone WB. 2009. Bat white-nose syndrome: an emerging fungal pathogen? Science 323:227. doi:10.1126/science.1163874.
12.Garcia-Solache MA, Casadevall A. 2010. Global warming will bring new fungal diseases for mammals. mBio 1:e00061-10. doi:10.1128/mBio.00061-10.
13.de Crecy E, Jaronski S, Lyons B, Lyons TJ, Keyhani NO. 2009. Directed evolution of a filamentous fungus for thermotolerance. BMC Biotechnol 9:74. doi:10.1186/1472-6750-9-74.
14.Robert V, Cardinali G, Casadevall A. 2015. Distribution and impact of yeast thermal tolerance permissive for mammalian infection. BMC Biol 13:18. doi:10.1186/s12915-015-0127-3.
15.McClean MA, Angilletta MJ, Jr., Williams KS. 2005. If you can’t stand the heat, stay out of the city: thermal reaction norms of chitinolytic fungi in an urban heat island. J Therm Biol 20:384–391. doi:10.1016/j.jtherbio.2005.03.002.
16.Cendejas-Bueno E, Kolecka A, Alastruey-Izquierdo A, Theelen B, Groenewald M, Kostrzewa M, Cuenca-Estrella M, Gomez-Lopez A, Boekhout T. 2012. Reclassification of the Candida haemulonii complex as Candida haemulonii (C. haemulonii group I), C. duobushaemulonii sp. nov. (C. haemulonii group II), and C. haemulonii var. vulnera var. nov.: three multiresistant human pathogenic yeasts. J Clin Microbiol 50:3641–3651. doi:10.1128/JCM.02248-12.
17.Chen YL, Konieczka JH, Springer DJ, Bowen SE, Zhang J, Silao FG, Bungay AA, Bigol UG, Nicolas MG, Abraham SN, Thompson DA, Regev A, Heitman J. 2012. Convergent evolution of calcineurin pathway roles in thermotolerance and virulence in Candida glabrata. G3 (Bethesda) 2:675–691. doi:10.1534/g3.112.002279.
18.Osland MJ, Gabler CA, Grace JB, Day RH, McCoy ML, McLeod JL, From AS, Enwright NM, Feher LC, Stagg CL, Hartley SB. 2018. Climate and plant controls on soil organic matter in coastal wetlands. Glob Change Biol 24:5361–5379. doi:10.1111/gcb.14376.
19.Stone W, Jones BL, Wilsenach J, Botha A. 2012. External ecological niche for Candida albicans within reducing, oxygen-limited zones of wetlands. Appl Environ Microbiol 78:2443–2445. doi:10.1128/AEM.06343-11.
20.Chatterjee S, Alampalli SV, Nageshan RK, Chettiar ST, Joshi S, Tatu US. 2015. Draft genome of a commonly misdiagnosed multidrug resistant pathogen Candida auris. BMC Genomics 16:686. doi:10.1186/s12864-015-1863-z.
21.Mentel M, Spirek M, Jorck-Ramberg D, Piskur J. 2006. Transfer of genetic material between pathogenic and food-borne yeasts. Appl Environ Microbiol 72:5122–5125. doi:10.1128/AEM.00293-06.
22.Bornman JF, Barnes PW, Robson TM, Robinson SA, Jansen MAK, Ballare CL, Flint SD. 2019. Linkages between stratospheric ozone, UV radiation and climate change and their implications for terrestrial ecosystems. Photochem Photobiol Sci 18:681–716. doi:10.1039/C8PP90061B.
23.Dadachova E, Bryan RA, Huang X, Moadel T, Schweitzer AD, Aisen P, Nosanchuk JD, Casadevall A. 2007. Ionizing radiation changes the electronic properties of melanin and enhances the growth of melanized fungi. PLoS One 2: e457. doi:10.1371/journal.pone.0000457.
24.Al-Yasiri MH, Normand A-C, L’Ollivier C, Lachaud L, Bourgeois N, Rebaudet S, Piarroux R, Mauffrey J-F, Ranque S. 2016. Opportunistic fungal pathogen Candida glabrata circulates between humans and yellow-legged gulls. Sci Rep 6:36157. doi:10.1038/srep36157.
25.Yue H, Bing J, Zheng Q, Zhang Y, Hu T, Du H, Wang H, Huang G. 2018. Filamentation in Candida auris, an emerging fungal pathogen of humans: passage through the mammalian body induces a heritable phenotypic switch. Emerg Microbes Infect 7:188. doi:10.1038/s41426-018-0187-x.
26.Chow NA, Gade L, Tsay SV, Forsberg K, Greenko JA, Southwick KL, Barrett PM, Kerins JL, Lockhart SR, Chiller TM, Litvintseva AP, Adams E, Barton K, Beer KD, Bentz ML, Berkow EL, Black S, Bradley KK, Brooks R, Chaturvedi S, Clegg W, Cumming M, DeMaria A, Dotson N, Epson E, Fernandez R, Fulton T, Greeley R, Jackson B, Kallen A, Kemble S, Klevens M, Kuykendall R, Le NH, Leung V, Lutterloh E, Mcateer J, Pacilli M, Peterson J, Quinn M, Ross K, Rozwadowski F, Shannon DJ, Skrobarcek KA, Vallabhaneni S, Welsh R, Zhu Y. 2018. Multiple introductions and subsequent transmission of multidrug-resistant Candida auris in the USA: a molecular epidemiological survey. Lancet Infect Dis 18:1377–1384. doi:10.1016/S1473-3099(18)30597-8.
27.↵Bahn YS, Kojima K, Cox GM, Heitman J. 2006. A unique fungal two-component system regulates stress responses, drug sensitivity, sexual development, and virulence of Cryptococcus neoformans. Mol Biol Cell 17:3122–3135. doi:10.1091/mbc.e06-02-0113.
28.Day AM, McNiff MM, da Silva Dantas A, Gow NAR, Quinn J. 2018. Hog1 regulates stress tolerance and virulence in the emerging fungal pathogen Candida auris. mSphere 3:e00506-18. doi:10.1128/mSphere.00506-18.
29.Adams E, Quinn M, Tsay S, Poirot E, Chaturvedi S, Southwick K, Greenko J, Fernandez R, Kallen A, Vallabhaneni S, Haley V, Hutton B, Blog D, Lutterloh E, Zucker H, Candida auris Investigation Workgroup. 2018. Candida auris in healthcare facilities, New York, USA, 2013–2017. Emerg Infect Dis 24:1816–1824. doi:10.3201/eid2410.180649.
30.Munoz JF, Gade L, Chow NA, Loparev VN, Juieng P, Berkow EL, Farrer RA, Litvintseva AP, Cuomo CA. 2018. Genomic insights into multidrug-resistance, mating and virulence in Candida auris and related emerging species. Nat Commun 9:5346. doi:10.1038/s41467-018-07779-6.
Referência: Arturo Casadevall, Dimitrios P. Kontoyiannis e Vincent Robert
American Society for Microbiology
Adaptado por Portal Tratamento de Água
Traduzido por Gheorge Patrick Iwaki